脳卒中の詳しい治療について
脳梗塞の内科的治療、予防薬について
正常な状態では血液は流動性を持ち、血管内、心腔内で凝固することはない。しかしある病態では血管を閉塞し血流を途絶させたり、心腔内で血栓を形成し遊離し塞栓を引き起こす。このようなことが脳血管に起こると脳梗塞を生じることとなる。虚血性脳血管障害(脳梗塞、TIA)の治療にはその血流回復、あるいは血管閉塞の予防のために抗血栓療法が行われる。抗血栓療法には抗血小板療法、抗凝固療法、血栓溶解療法がある。動脈硬化などによる損傷血管への血小板の粘着後、血小板が凝集し白色血栓となる所を阻止するために抗血小板薬が用いられる。さらにフィブリンが形成され赤色血栓となる所を阻止するために抗凝固療法が用いられる。そして完成した血栓自体を溶解するためには血栓溶解薬が使用される。
抗血小板療法
抗血小板薬して望まれる作用はアテローム硬化による血管内腔狭窄部位に血小板が凝集し血管を閉塞させることを防ぐことすなわち血小板凝集抑制作用である。 血小板凝集機構にはアラキドン酸カスケードとサイクリックAMPを介する系が重要である。幾つかの作用機序の異なる抗血小板薬があり、作用部位からサイクロオキシゲナーゼ阻害薬、フォスフォリジエステラーゼ阻害薬、トロンボキセンA2(TXA2)合成阻害薬、プロスタサイクリン(PGI2)とその誘導体、グリコプロテインIIb/IIIa阻害薬などに分類されている。このように多数の薬剤が血小板凝集抑制機能を有するとされるが、実際の常用量の経口投与で明らかな血小板凝集抑制作用を示すものはさほど多くない。現在、臨床的に効果を認められている抗血小板薬は経口薬としてアスピリン、チクロピジン、シロスタゾールがあり、点滴静注としてオザグレルが使用される。以下それぞれにつき概説する。
アスピリン

アスピリンは世界中で頻用されている薬剤であり、その作用部位はシクロオキシゲナーゼをアセチル化し、アラキドン酸からのプロスタグランジンエンドペルオキシド生成を抑制することで血小板内では強い凝集活性を有するTXA2の生成を抑制し、血管内皮細胞では逆に強い凝集抑制作用を有するPGI2の生成を抑制する。このようなアスピリンの作用は抗血栓という点では相反することになり、“アスピリンジレンマ”と言われる。アスピリンに対する研究から、血小板のサイクロオキシゲナーゼは血管内皮細胞のそれよりアスピリンの感受性が高く、抑制を受けやすいこと、少量反復投与では血小板では抑制作用が蓄積するが、内皮細胞では蓄積効果が乏しいことなどが判明した。このことからアスピリンの少量投与が血小板のみにその効果をもたらし、血栓予防に効果があるとされ、現在普及している。アスピリンの効果は不可逆的であり、血小板寿命の期間中(正常状態で約9日間、血栓傾向では短縮)持続する。投与;現在は少量投与が勧められ日本では小児用バファリン(81mg)が使用されることが多い。欧米では300mg以上の投与が必要という主張もある。多数例の検討からは至適用量は75ー325mgとされている。
副作用;胃腸障害が最も問題である。このほかアスピリンによる気管支喘息の誘発も問題となる。投与前の胃腸障害、喘息の既往症チェックが必要である。
チクロビジン

チクロピジンはその作用機序が不明な点も多い。In vitroでの血小板凝集抑制効果がないにも関わらず、投与後約24時間でADPによる凝集が低下することより、代謝産物に抑制効果があると推測されているが完全には解明されてはいない。血小板でGi蛋白を含む抑制シグナル伝達を阻害することで血小板アデニル酸シクラーゼ活性を高めサイクリックAMPが増加することで凝集を阻害する機序や、フィブリノーゲンの血小板膜糖蛋白IIb/IIIaへの結合阻害の機機序などが考えられている。アスピリンと同様に血小板寿命の期間中(約9日間)作用する。
副作用:無顆粒球症が最も重篤な副作用であり投与開始後2カ月間は注意を要する。稀ではあるが投与後かなり経過してから(6週以降でも)発症することがあり注意する。一旦発症してしまうと強い骨髄抑制のため致死的となることもある。このほか出血、TTP、肝障害(肝障害型、胆汁うっ滞型など)や下痢、大腸炎なども知られている。
クロビドグレル
チクロピジンと同じチエノピリジン骨格を有し、チクロピジンより安全性が高いとされる。アスピリンと同様に血小板寿命の期間中(約9日間)作用する。 アスピリンでも存在するがクロピドグレルが有効に血小板機能を抑制できない方々がいると言われ、再発の場合は考慮が必要。
シロスタゾール

フォスフォジエステラーゼの阻害薬であるシロスタゾールは脳梗塞の中でも他の薬剤の効果が明らかでなかったラクナ梗塞に対し有効であるとされている。単なる血小板凝集作用のみならず血管内皮に対する作用、血管拡張作用などの関与が考えられている。
副作用:頻脈、頭痛など 狭心症などには投与注意
オザグレル
TXA2合成酵素阻害薬であるオザグレルナトリウムは血小板凝集、血管収縮作用を抑え、PGI2の産生を増加することで、微小循環改善、梗塞巣の容積減少を招くことが、動物実験、あるいはヒトでの多施設共同実験で示され、14、28日後の運動機能を有意に改善している。急性期に用いられ、特に穿通枝系の脳梗塞(ラクナ梗塞)に有効であるとされている。
使用:一回量80mgを適当量の電解質液、糖質液に溶解し、朝、夕2回それぞれ2時間かけて点滴静注。約2週間連続して行う。
使用禁忌:出血性梗塞、脳塞栓症(心原性、動脈原性)、出血性病変 (原則禁忌)重篤な意識障害を伴う大梗塞、脳塞栓症のおそれのある、心房細動、徐脈を伴った虚血性心疾患、陳旧性心筋梗塞
副作用:出血傾向、肝障害、嘔気、嘔吐など
ジビリダモール
フォスフォジエステラーゼの阻害薬であるジピリダモールは代表的な抗血小板薬として一時期用いられたが、ATPの評価では効果は不十分であるとされ、その使用は下火となった。その後、ESPS-2での検討では、やはり単独でも効果があり、アスピリンとの併用でさらに相加的な効果があると報告されている。アスピリンとジピリダモールの合剤が海外では販売されているが日本では未発売(今のところ発売の予定なし)
副作用:頭痛、めまい、熱感、心悸亢進など
抗凝固療法
抗凝固療法は、心原性脳塞栓の再発予防にはファーストチョイスとして考えられる。主として抗凝固療法は静脈血栓に用いられるが、脳塞栓を引き起こす左心系で形成される血栓は動脈血ではあるが乱流などのため血流が遅い部位に形成されるフィブリンに富んだ血栓であり、抗血小板薬より抗凝固薬の適応となる。 このほか進行性脳卒中(脳底動脈血栓症など)や、TIAが頻発し、発作の間隔が短縮し、発作の持続が延長するいわゆるcrescendo TIAでは脳梗塞への移行、進展を防ぐ目的で抗凝固薬が使用される。
ヘパリン
ヘパリンは肝臓から抽出された酸性多糖類であり、肝臓のラテン名であるheparにその名前は由来する。ヘパリンは血中のアンチトロンビンIIIと複合体を形成し、活性型凝固因子IXa,Xa、IXa、トロンビンを不活化し、その効果を発現させる。ヘパリンは未分画であり、分子量4000ー20000位の物質の混合であり、単一の物質ではない。ヘパリンのコントロール;ヘパリンの効果はプロトロンビン時間(PT)にはあまり反映せず、活性化部分トロンボプラスチン時間(APTT)に反映される。APTTを正常の1.5-2.5倍程度にコントロールしてゆく。
低分子ヘパリン
低分子ヘパリンはXa因子に対する効果が強く、トロンビンはあまり不活化されないために出血の合併症は少なく、患者による効果の差が少ない。ヘパリンと違い、分子量の差から主としてその結合がビトロネクチンであることと関連している。ヘパリンの副作用:出血が最大の副作用であり、過量投与の場合半減期が短く中止のみ出よいことが多い。必要であれば、硫酸プロタミンを投与する。(ヘパリン1000単位にプロタミン10ー15mg。血圧降下を招かぬよう緩徐に投与。) また、一見奇異ではあるが、副作用として連用によるアンチトロンビンIII低下による血栓形成や、出現頻度は低いが血小板4因子との複合体に対する抗体形成から血小板凝集、活性を生じ、血小板減少とともに血栓形成を招くことがある。
ワーファリン

ワーファリンは北米で1920年代に発生した牛の出血の奇病スウィートクローバー病にその発見は由来する。原因となった毒物はダイクマロールであり、その構造がビタミンKに類似し、これに依存する凝固因子の阻害がその機構であった。この誘導体がワーファリンであり、その名前は発見した研究所(Wisconsin Agricultural Research Foundation;(WARF)) に由来する。抗凝固作用の持続時間は薬そのものよりビタミンK依存の凝固因子の半減期に依存する。ちなみに半減期が一番短いのは第VII因子である。本薬剤は患者によりその効果に大きな差があり、有効な投与量は各患者で調整する必要がある。また、さまざまな併用薬剤でその効果は変化し、このコントロールの煩雑さが最大の欠点である。ヘパリンとは異なりAPTTはあまり変化せず、コントロールには第VII因子を反映するプロトロンビン時間(PT)あるいは、トロンボテストが用いられる。トロンボテスト、PTの測定は各施設で完全に一致するものではなく、現在は統一性のあるPT-INR (International Normalized Ratio)の値として示される。INR2.0-3.0が望ましい値とされるが、近年の日本人での研究では1.6以上であれば十分効果があるとされ、70歳以上では1.6~2.6のコントロールが推奨されている。
投与例:緊急に作用させたいときは1日5mgを3日間投与し、その後PT-INRを測定し、最適な量を、増減し決めてゆくが、緊急性が求められる時は新規抗凝固薬も考慮。急がない場合は1mgより徐々にPT-INRチェックしながら増量する。大体1ー5mgの間でコントロール可能であることが多い。
食事の影響を受けることを注意する。特に納豆は納豆菌がビタミンKを産生し効果をなくすため禁止、クロレラ、緑色野菜のほうれんそう、ブロッコリーなどはビタミンKを多く含有するため摂取量に注意。
アルガトロバン
選択的抗トロンビン薬であり、アンチトロンビンIIIと関係なく抗凝固作用を示す。フィブリン血栓形成阻害作用、血小板凝集阻害作用、血管収縮抑制作用等があるとされる。発症後48時間以内のアテローム血栓性脳梗塞がその適応とされる。ラクナ梗塞への有効性は示されていない。
ダビガトラン
トロンビン阻害薬でありフィブリン生成を抑制する。ワーファリンとの対比では(RELY試験)脳卒中の発生率、副作用としての出血は少ないとされるが実際の使用では出血による危険性も指摘されている。ワーファリンのように血液検査をしてコントロールする必要はないが、APTTや腎機能障害につき投与前にチェックが必要。クレアチニンクリアランス30ml/minでは使用禁忌。ややカプセルは大きめで服用に注意。胃腸障害が多い。カプセルから中身を出しての服用はNG。
リバ-ロキサバン
凝固因子のXa因子を選択的に阻害し、トロンビンの生成を阻害する。J-ROCKET AFという日本人心房細動者を対象とした試験でワルファリンよりも再発抑制効果が示された。出血などの副作用は同等。 腎機能障害時(クレアチニンクリアランス15-49ml/min)は低容量を投与する。
血栓溶解療法
理論的には血管を閉塞した血栓を溶かし、再開通できれば、脳梗塞に到らずに正常に戻すことができる。脳梗塞をなおすと言う意味では最も期待される治療である。しかし、血栓を溶解し、再開通させても、経過時間が長いと臨床的改善は難しく、逆に脳に出血性病変を招く危険が高まる。1960ー70年代にはウロキナーゼ、ストレプトキナーゼといった第一世代の血栓溶解薬が試されたが、出血の合併症の多さから、欧米ではむしろ禁忌とされた。1980年代には問題となる血栓への親和性の高い組織プラスミノゲンアクチベーターが急性心筋梗塞の治療に成功をおさめ、脳血管障害への応用が始まった。多数例からの検討により、発症3時間以内が適応で神経学的所見などの基準をクリアした例に限り用いられる。出血が合併症として最も問題であり、投与で出血すの合併症は10倍になるとされている。現実には発症3時間以内に来院し、診断がつく例はそれほど多くはなく、脳梗塞の治療への社会的認識の普及も重要な課題である。
理論的には血管を閉塞した血栓を溶かし、再開通できれば、脳梗塞に到らずに正常に戻すことができる。脳梗塞をなおすと言う意味では最も期待される治療である。しかし、血栓を溶解し、再開通させても、経過時間が長いと臨床的改善は難しく、逆に脳に出血性病変を招く危険が高まる。1960ー70年代にはウロキナーゼ、ストレプトキナーゼといった第一世代の血栓溶解薬が試されたが、出血の合併症の多さから、欧米ではむしろ禁忌とされた。1980年代には問題となる血栓への親和性の高い組織プラスミノゲンアクチベーターが急性心筋梗塞の治療に成功をおさめ、脳血管障害への応用が始まった。多数例からの検討により、発症3時間以内が適応で神経学的所見などの基準をクリアした例に限り用いられる。出血が合併症として最も問題であり、投与で出血すの合併症は10倍になるとされている。現実には発症3時間以内に来院し、診断がつく例はそれほど多くはなく、脳梗塞の治療への社会的認識の普及も重要な課題である。
血栓溶解薬
ウロキナーゼ
ウロキナーゼは日本でかつてよく用いられた第一世代の血栓溶解薬である。プラスミノーゲンをプラスミンに変換し、フィブリンを溶解する作用がある。少量の投与では血中のα2ープラスミンインヒビターにより不活化されて失活し、大量ではフィブリノゲンを分解し、出血性の合併症を招きやすいという欠点がある。現在保険では6万単位の投与が認められてはいるが、効果を期待することはできない。但し、24万単位の局所的投与での有効例は多いともされている。
t-PA(組織プラスミノゲンアクチベーター)
第二世代の血栓溶解薬として、症例を選び投与が行われる。ウロキナーゼと同じ作用機序を持つが、固相のフィブリンに親和性が高く、酵素活性が血栓の上で発現する。このため閉塞部位での血栓溶解性が増し、全身的な影響を少なくすることが期待される。しかし治験の結果からは決して出血性合併症が少ないとは言えず、また、その使用には症例を選択して行うべきであるとされている。即ち、発症4.5時間以内の症例に限定し、起床時に明らかとなった症例は適応外とする、CTで脳溝の圧排、mass effect、浮腫、出血のある例には用いない、血圧の厳密なコントロールを行う、脳外科的処置が可能な施設で行うなどの制限付き使用が勧められている。 現在、プロウロキナーゼ、APSAC (anisosylated plasminogen streptokinase activator complex)、ミュータントt-PAなどのより安全で有用な抗血栓薬の開発が進められている。
脳保護剤
エダラボン
フリーラジカルスカベンジャーという薬効を持つラジカットという薬品が、脳に障害を生じたときにその被害を最小限にとどめる目的で単独使用あるいは、併用で用いられる。その性質上発症後24時間以内に投与の開始が必要で14日間以内の使用が許されている。近年、t-PA使用時の出血軽減に効果があるという報告もある。腎障害を生じることもあり、腎障害のある場合は投与が禁忌となる。
抗脳浮腫療法
高張グリセロール
血管内に高張液を急速に投与し血液の浸透圧を上げ、脳組織より血管内へ浮腫液を引き込み脳浮腫を軽減させる。高齢者では心負荷軽減が必要であれば一般保液は投与中中止する。(グリセオール500mlで塩分4.5g分の負荷となる)
マンニトール
高張グリセオールより強い脳浮腫の軽減効果がある。切迫脳ヘルニアの時などに使用。中止後のリバウンドも大であり中止時は注意する。
外科的治療 頚動脈内膜剥離術
1970年代に頚動脈再建術が報告されて以来頚動脈内膜剥離術は欧米で普及した。日本も食生活の変化により以前は少ないとされた頚動脈の動脈硬化病変が多くなり、適応例の頻度が増加している。頚動脈内膜剥離術は脳梗塞の発症を予防することが目的であり頚動脈内の動脈硬化性病変を取り去るために行われ、術式はほぼ完成されたものである。無症候性病変についてはAsymptomatic Carotid Atherosclerosis Study (ACAS)でと症候性病変についてはNorth American Symptomatic Carotid Endarterectomy Trial (NASCET)とEuropean Carotid Surgery Trial (ECST)でそれぞれにつき検討され、70ー99%の頚動脈狭窄を有する例では有用であり、適応があると考えられている。しかし、無症候性病変は年間発症率が約1ー2%であり、その適応にはまだ検討が必要とする意見がある。術中・術後の合併症として頚動脈の血流遮断による脳梗塞や、操作に伴う血栓塞栓が報告されている。
血管内外科の現状と将来
難治性の脳血管病変を開頭することなく、治療する脳神経血管内外科は、低侵襲で完治させることができる例もあり、再発率も低く、またコストパフォーマンスにすぐれている画期的な治療法である。
歴史的には1970年代に離脱式バルーンが開発され、これを用いた動脈瘤、脳動静脈奇形、頚動脈海綿静脈瘻の治療が試みられた。これとともにバルーンの硬化剤も開発された。同時期より、脳内の血管にカテーテルを進める技術開発がなされ、まずcalibrated leak baloon catheterという先端に小さい特殊な風船のついたカテーテルが開発された。80年代にはprogressive suppleness microcatheterという先へゆくほど細くなるマイクロカテーテルが開発され、さらにこれをガイドワイヤーで操作するテクニックが開発された。これらを利用し、脳動静脈奇形の治療などが行われた。80年代終わりには離脱式コイルがGuglielmiにより開発された。これは脳動脈瘤に進めたカテーテルの先からはんだづけしたプラチナコイルを進め、通電することで離脱させ動脈瘤を埋めるという画期的な方法であった。その後様々な離脱式コイルが考案されている。
脳動脈瘤の瘤内塞栓術
脳動脈瘤の手術は従来開頭して動脈瘤をネッククリッピングが最良の方法とされてきた。近年ググリエルミ デタッチャブル コイル (GDC)の開発により血管内治療が飛躍的に行われることとなった。日本でも1997年の認可以来、多数の症例が経験されてきている。しかし、この方法にも問題が無いわけではなく、術中に生じる合併症は決して軽くないものもあり、適応症例の選択、、安全性、合併症の予防などにつき充分な検討が必要である。近年GDCコイルに変わる新しい素材のコイルも開発されその確実性は増している。また、2本のカテーテルを使用して通常塞栓術の困難な動脈瘤に塞栓を行ったり、その手技は年々進化している。
メモ ググリエルミ デタッチャブル コイル (GDC)
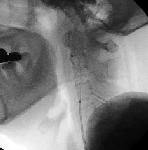
下図のように塞栓を行う。
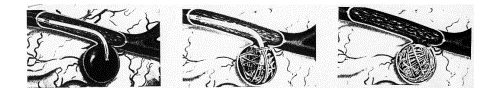
カテーテルの先を動脈瘤に誘導し、コイルを挿入し塞栓を形成させる。 矢印の部位にコイルが挿入されている。
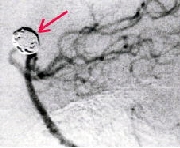
虚血性脳血管障害に対する血管内療法
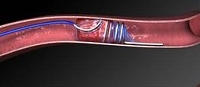
虚血性脳血管障害に対しては脳塞栓に対する血栓溶解療法が80年代からカテーテルを用いて行われるようになり、選択的な投与の有用性が示されてきている。しかし血栓溶解療法は発症後間もない(できれば3時間以内)症例に限られ、その適応例が現実には少ないことが一つの問題である。心筋stent.JPG梗塞のように迅速な搬送、治療へのとりかかりができるように病態に対する啓発も必要と思われる。 このほか頭蓋内狭窄血管に対しては頭蓋内血管拡張術が、バルーンカテーテルを用いて試みられつつある。頭蓋外血管(頚動脈、椎骨動脈、鎖骨下動脈)に対しては頭蓋外血管拡張術としてバルーンカテーテルを用いたり、血管内留置ステントの併用が行われている。 現在は頭蓋内の血管への適応は推奨されてはいないが、今後このような手技が発展し、狭心症で行われたような狭窄部位に対する血管形成が進歩し、虚血性脳血管障害の予防が可能となってゆくものと思われる。 現在Merci deviceと呼ばれるコルクの栓抜きのように頚動脈の血栓を除去する機器も開発されている。
